Un fármaco experimental muestra su eficacia contra el alzhéimer, pero se asocia a efectos secundarios graves
- Los datos del ensayo clínico evidencian que lecanemab consigue frenar el deterioro cognitivo en un 27% de los casos
- También se relaciona con una inflamación del cerebro en un 12,6% de los participantes, con dos muertes reportadas

Lecanemab, el fármaco experimental para tratar el alzhéimer que ha sido desarrollado por Eisai y Biogen, ha demostrado su eficacia para frenar el deterioro cognitivo en un 27% de los casos, aunque también se ha asociado a efectos secundarios graves, con el fallecimiento de dos pacientes, según los datos del ensayo clínico presentado por las dos compañías farmacéuticas.
La administración del medicamento se asoció con una inflamación del cerebro en un 12,6% de los participantes del ensayo, un efecto secundario ya detectado en fármacos similares. El 14% de los pacientes padecieron microhemorragias cerebrales, mientras que otros cinco pacientes sufrieron hemorragias de mayor consideración.
Los dos fallecimientos están siendo analizados en detalle para determinar si estuvieron causados por la administración del medicamento. Por ello, las conclusiones del estudio recalcan que el fármaco "fue asociado con efectos adversos" y subrayan la necesidad de "ensayos más prolongados para determinar la eficacia y la seguridad del lecanemab en el alzhéimer temprano".
Los datos del ensayo clínico, que se han publicado en The New England Journal of Medicine, muestran que el tratamiento con lecanemab redujo la demencia clínica en un 27% en comparación con un placebo. En el estudio participaron 1.800 pacientes de entre 50 y 90 años, en fase temprana de alzhéimer, a los que se les hizo un seguimiento durante 18 meses.
"Todos estos medicamentos reductores de amiloide conllevan un riesgo de mayor hemorragia cerebral", ha valorado Ronald Petersen, de la Clínica Mayo en Rochester (Estados Unidos), quien recalca que "tanto en los resultados principales, como en los secundarios, la reducción de amiloide es bastante impresionante".
Petición a la FDA para que lo apruebe
Para la Asociación de Alzhéimer de Estados Unidos, los datos del ensayo clínico confirman que el fármaco "puede cambiar significativamente el curso de la enfermedad para las personas en las etapas más tempranas de la enfermedad de Alzheimer", y ha hecho un llamamiento a los organismos reguladores del país para que aprueben por vía urgente la comercialización del fármaco.
La agencia reguladora de medicamentos de Estados Unidos, la FDA, tiene previsto decidir el próximo 6 de enero si aprueba lecanemab bajo su programa de revisión acelerada, que requiere la prueba de que el fármaco afecta a un biomarcador asociado, como la reducción de beta amiloide en el caso del alzhéimer. Independientemente de esa decisión, la farmacéutica Eisai planea solicitar en breve la aprobación estándar de la propia FDA para el medicamento y también buscará su autorización en la Unión Europea y en Japón.
Después de conocerse los resultados del ensayo clínico, las acciones de la compañía japonesa Eisai subieron un 3%, mientras que las de la estadounidense Biogen, un 0,9%. Desde el anuncio de los primeros datos del ensayo a finales de septiembre, las acciones de ambas compañías se han disparado un 60% y un 47%, respectivamente.
Ensayo clínico "exitoso"
En declaraciones a SMC España, Raquel Sánchez-Valle, jefa de servicio de Neurología del Hospital Clínic de Barcelona, ha destacado que "los resultados anunciados se mantienen tras la revisión por pares". Esta neuróloga también destaca el "beneficio significativo del tratamiento con lecanemab a los 18 meses de tratamiento", ya que se ralentiza hasta un 27% el deterioro cognitivo, lo que indica que el estudio es exitoso porque "se diseñó para identificar una diferencia igual o superior al 25%".
En la misma línea, Marc Suárez-Calvet, investigador del IMIM-Hospital del Mar, opina que "el ensayo clínico demuestra su objetivo principal: existe un menor deterioro cognitivo y funcional en el brazo de tratamiento comparado con el de placebo".
"El estudio también demuestra que lecanemab reduce de forma importante el acúmulo de amiloide en el cerebro. También es mejor que el placebo en todos los objetivos secundarios estudiados, que incluyen otras escalas cognitivas y biomarcadores biológicos. En conclusión, se trata de un estudio bien diseñado, riguroso y que apunta a un efecto beneficioso de lecanemab en las fases iniciales del alzhéimer", agrega.
Sobre los efectos adversos detectados, este neurólogo declara que "habrá que estudiar si estos fallecimientos son atribuibles al fármaco o a otras razones. Dado que el alzhéimer es una enfermedad heterogénea, será importante determinar qué pacientes puede potencialmente beneficiarse más de este tratamiento y quiénes de ellos tienen un mayor riesgo de efectos secundarios".
Eliminación de amiloide
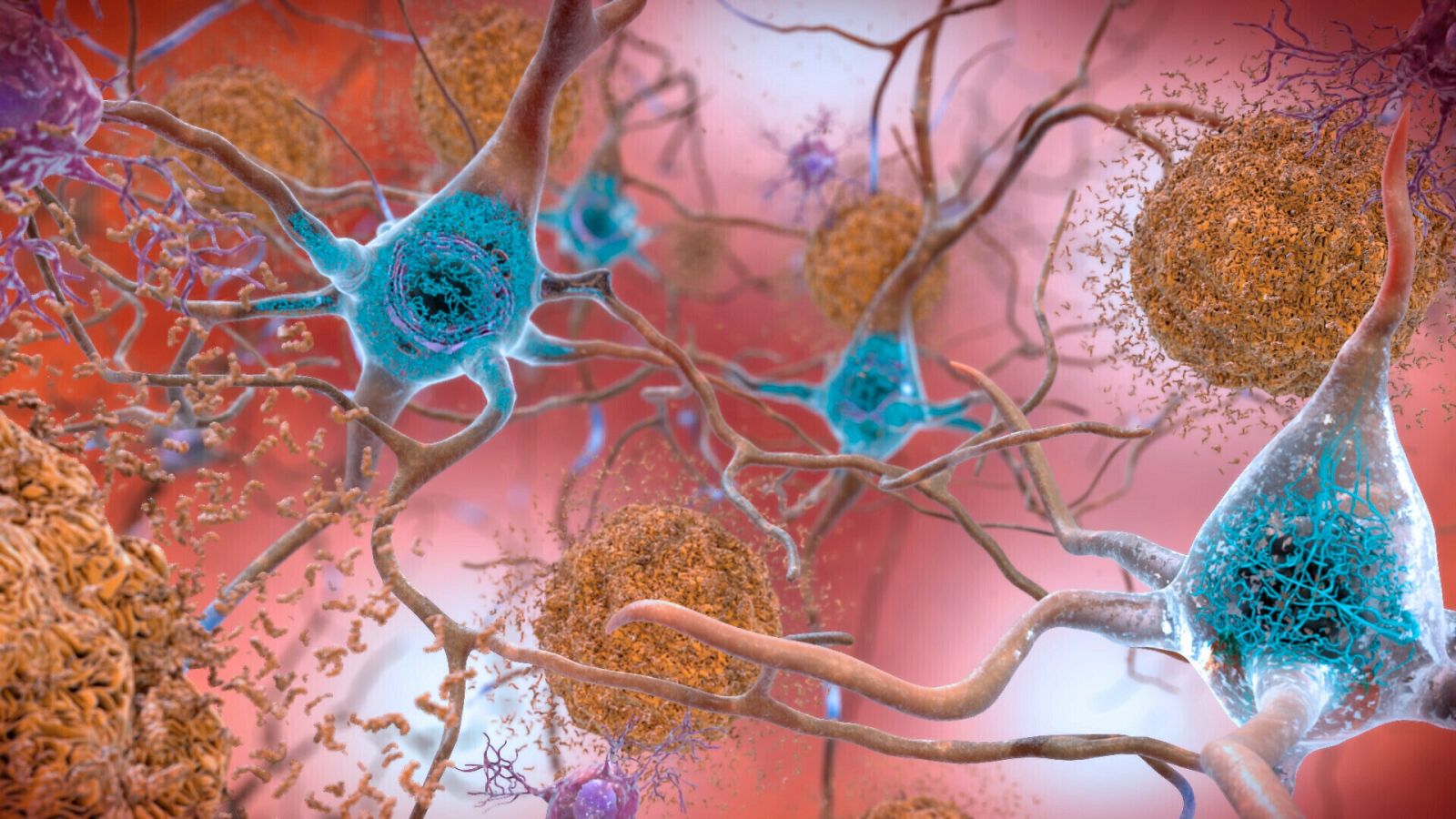
Lecanemab es un anticuerpo monoclonal intravenoso, diseñado para eliminar los depósitos de amiloide. Aunque, a diferencia de otros medicamentos experimentales similares, se dirige a las formas de amiloide que no aún no se han agrupado. Una de las principales hipótesis del origen del alzhéimer es la formación de placas de amiloide que impiden la conexión entre las neuronas y provocan su degeneración, aunque hasta ahora no se ha demostrado de manera concluyente.
Así, lecanemab está diseñado para prevenir la progresión del alzhéimer mediante la unión de un anticuerpo al beta amiloide (que se presenta en acumulaciones anormales en el cerebro de los pacientes con esta enfermedad, la forma más común de demencia) y su eliminación, para evitar la destrucción de células nerviosas.




