Científicos crean por primera vez un modelo de embrión temprano a partir de células de la piel
- Estas células reprogramadas permitirán desarrollar nuevas terapias para tratar la infertilidad
- Este avance reabre el debate ético, aunque de momento estos embriones no son capaces de implantarse en el útero

Dos equipos distintos de científicos han creado "estructuras similares" a embriones humanos a partir de células de la piel. Un logro que hasta ahora solo se había alcanzado en ratones. Estas células reprogramadas permitirán ampliar los conocimientos sobre las primeras etapas del desarrollo embrionario, donde comienzan a aparecer los problemas congénitos, así como desarrollar nuevas terapias para tratar la infertilidad.
Ambas investigaciones, una liderada por el argentino José Polo desde la Universidad Monash, Australia, y la otra por Jun Wu, de la Universidad de Texas Southwestern, EE. UU.; se han publicado este miércoles en la revista Nature, y han sido analizadas por dos expertos independientes, Yi Zheng y Jianping Fu.
Este nuevo avance científico reabrirá los debates públicos sobre las cuestiones éticas que enfrentan, aunque de momento estos embriones de laboratorio no son capaces de implantarse en el útero, y por tanto, de dar a luz a un ser humano.
De células de la piel a 'iBlastoides'
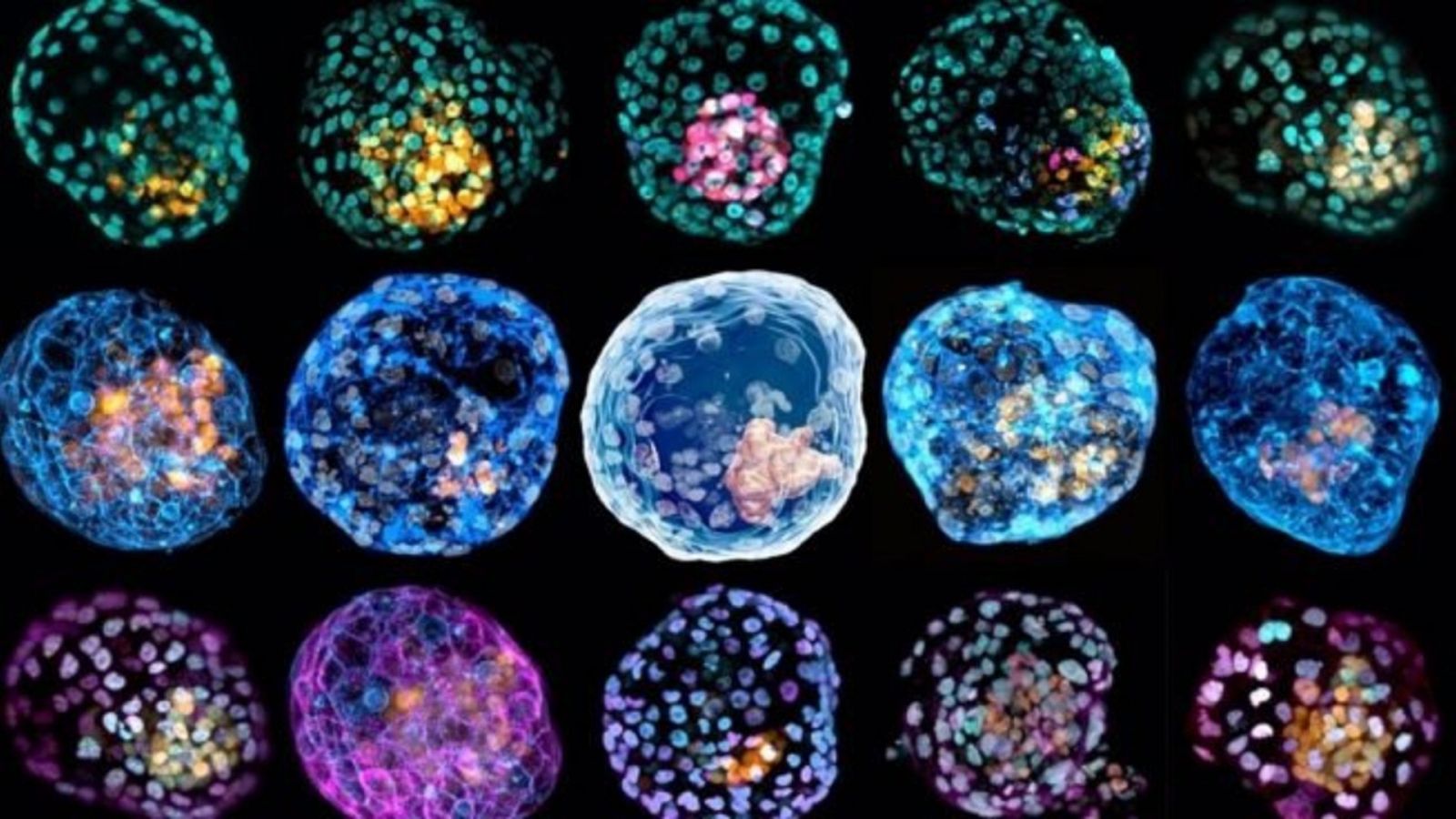
El equipo de investigación de Polo ha conseguido reprogramar las células de la piel humana -fibroblastos- en células madre pluripotentes inducidas (IPS) -un grupo de células que provee de nutrientes al embrión y se desarrolla como parte importante de la placenta-.
Con ello, pudieron producir modelos tridimensionales de blastocistos humanos. Los blastocistos corresponden a la fase temprana de los embriones mamíferos -los primeros 5 o 6 días de desarrollo-. En concreto, se trata de una estructura compleja formada por una masa celular interna de la que se origina el embrión y de una capa periférica de células que formará la placenta.
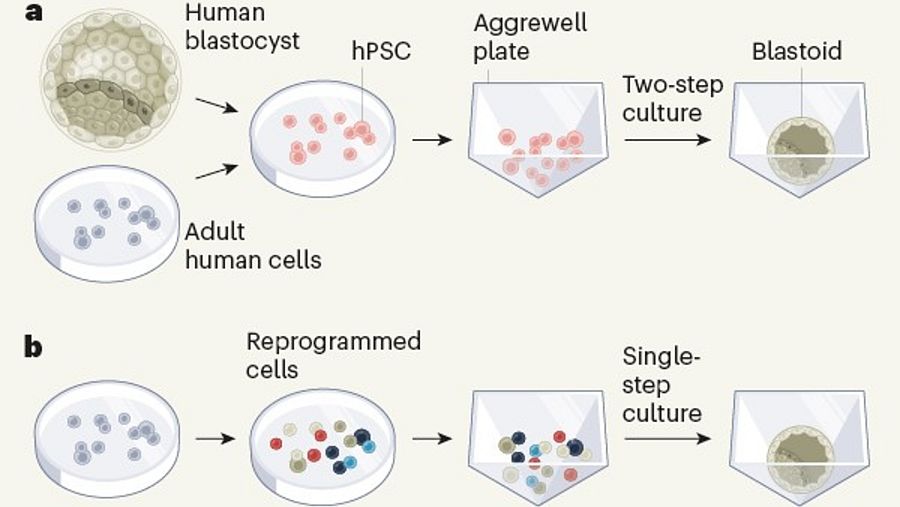
Generación de blastoides humanos por las investigaciones de a) Jun Wu y b) José Polo Nature
En el estudio dirigido por Jun Wu, obtuvieron las células madre pluripotentes tanto por la reprogramación de células humanas adultas como aislándolas de blastocistos humanos. Los autores colocaron las IPS en placas de cultivo en 3D -denominadas placas Aggrewell-, y utilizaron un proceso de cultivo en dos pasos para desencadenar la formación de blastoides humanos, según apunta la revista Nature.
Estos "conjuntos de células" que se han obtenido de las dos investigaciones se asemejan a los blastocistos humanos en su morfología, tamaño, número de células y en la composición de diferentes linajes de células.
En el caso del estudio liderado por Polo, los han denominado iBlastoides -blastoides inducidos-, la investigación dirigida por Wu los ha llamado blastoides humanos. El término blastoide viene derivado de las anteriores investigaciones realizadas con ratones.
No son embriones humanos, sino modelos
Hasta la fecha actual, para estudiar la fase temprana del desarrollo vital solo se contaba con embriones donados a la ciencia, los cuales, a pesar de la información valiosa que aportan, son muy difíciles de conseguir y sus usos son muy limitados.
Ahora son capaces de obtener cientos de iBlastoides mediantes las células de la piel, aunque recuerdan que estas estructuras no son verdaderamente como las humanas, y debido a razones éticas deben ser eliminadas antes de los 14 días de desarrollo.
Los dos modelos descritos en Nature celebran que lleguen a reproducir "aspectos clave" del desarrollo temprano, pero presentan un número de diferencias respecto a los embriones humanos por el que no deben considerarse como tales.
En declaraciones a otros medios, Polo ha mostrado su convicción de que estos blastoides inducidos no son capaces de implantarse en el útero, por lo que no pueden dar vida a un embrión viable.
Solucionar problemas de fertilidad y analizar el impacto de la COVID-19
Según diferentes estudios, entre el 25 y el 75% de los problemas de fertilidad tienen su origen en las dos primeras semanas del desarrollo embrionario, especifica Polo. Disponer de tantos blastoides humanos permitirá avanzar de forma más rápida en los estudios sobre la infertilidad.
A su vez, la alta disponibilidad de embriones tempranos de laboratorio servirá para analizar la influencia de distintos virus, como el provocado por la infección de SARS-CoV-2, así como de los fármacos en los primeros días de desarrollo humano.




