Medicamentos financiados: así deciden el Gobierno y las autonomías qué tratamientos paga la sanidad pública
- Medicamentos falsos: cómo detectarlos y evitarlos
- Envíanos consultas al 659 800 555 o a verificartve@rtve.es


Circulan en redes sociales mensajes que aseguran que la ministra de Sanidad, Mónica García, ha rechazado sufragar un fármaco contra el cáncer de mama metastásico. En VerificaRTVE te explicamos las razones por las que se desestimó la financiación de este tratamiento y cómo se decide en España qué medicamentos cubre la sanidad pública.
Un mensaje compartido más de 2.000 veces en X difunde una foto de la ministra de Sanidad y afirma: “¿Cómo puedes conciliar el sueño?”. La publicación adjunta la imagen de una noticia de un medio digital con el siguiente titular: “Mónica García rechaza financiar por caro un fármaco que reduce a la mitad las muertes por cáncer de mama”. Otro mensaje compartido más de 1.000 veces en la misma red social dice que “Mónica García se niega a financiar un fármaco que reduce un 50% el riesgo de muerte por cáncer de mama”.
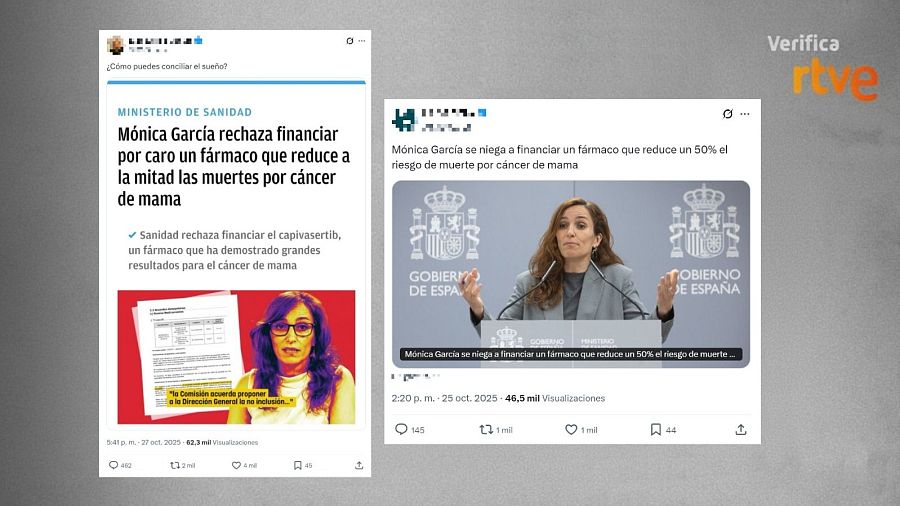
Mensajes que afirman que la ministra de Sanidad se niega a sufragar un fármaco para el cáncer de mama / VerificaRTVE
Razones de gasto público y existencia de alternativas terapéuticas
La Comisión Interministerial de Precios de los Medicamentos y Productos Sanitarios (CIPM) rechazó el pasado 16 de julio incluir un fármaco destinado al tratamiento de pacientes adultos con cáncer de mama avanzado entre los medicamentos financiados por el sistema sanitario público. Según consta en el acta de la sesión, el órgano acordó proponer a la Dirección General de Cartera Común de Servicios del SNS y Farmacia (DGCYF) su exclusión de la prestación farmacéutica del Sistema Nacional de Salud (SNS) por “criterios de racionalización del gasto público”, por “el impacto presupuestario que supondría su aprobación” y, además, por la existencia de alternativas terapéuticas para las mismas afecciones “a menor precio o con un coste de tratamiento inferior”.
Para tomar una decisión, la Comisión Interministerial cuenta entre otra información con los informes de posicionamiento terapéutico (IPT), que son evaluaciones sobre la eficacia y la seguridad del medicamento. Este es el IPT sobre el Truqap (capivasertib). Tras una consulta por correo electrónico, el Ministerio de Sanidad se remite a este informe y explica que se trata de un medicamento autorizado porque demostró eficacia. Según el Ministerio de Sanidad, el informe revela datos “inmaduros” sobre la supervivencia global que podría obtener este fármaco y que, por tanto, “existe incertidumbre” sobre sus efectos reales en este sentido. “El IPT concluye que dada la falta de evidencia directa e indirecta no es posible posicionar a capivasertib frente a otras opciones de tratamiento de segunda línea”, agrega el Ministerio (página 16 del IPT).
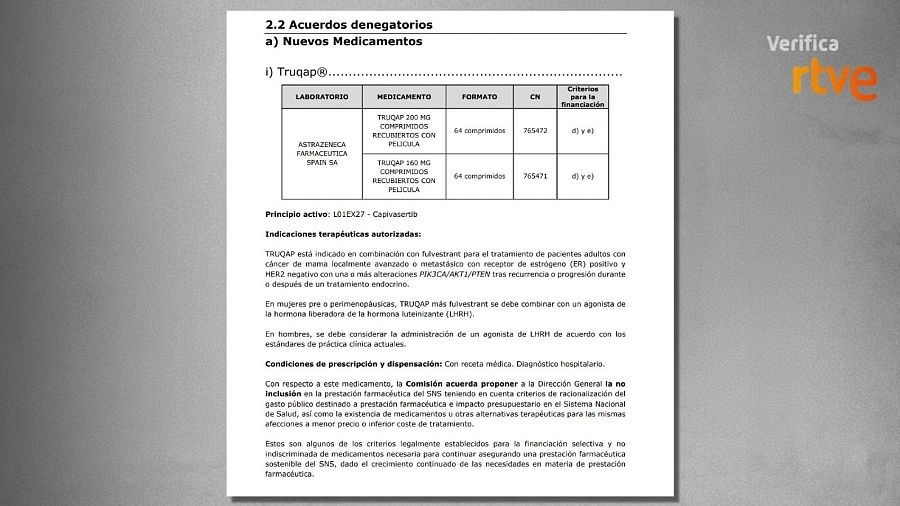
Página del acta donde se deniega la financiación pública del fármaco para tratar el cáncer de mama metastásico
Gobierno y CCAA deciden la financiación y los precios máximos
Los precios de los medicamentos están regulados e intervenidos por el Estado, como se explica en este documento del Ministerio de Sanidad. La Comisión Interministerial del Precio del Medicamento (CIPM) es el órgano encargado de fijar el precio industrial máximo de cada fármaco y de decidir sobre su financiación pública. Está adscrita al Ministerio de Sanidad e integrada por representantes técnicos del Gobierno y de las comunidades autónomas. Esta comisión toma sus decisiones por consenso, según el artículo 9.9 de su reglamento interno; si no hay consenso, “se procederá a votación” y se requerirá una mayoría simple.
El secretario de Estado de Sanidad, Javier Padilla, aseguró el pasado 28 de octubre en la Comisión de Sanidad del Congreso que en la CIMP “rara vez se vota y casi siempre se toman las decisiones por estricto consenso” (Diario de Sesiones del Congreso, página 4). Después, una resolución expresa de la Dirección General de Cartera Común de Servicios del SNS y Farmacia (DGCYF) formaliza la incorporación o exclusión del medicamento en la prestación farmacéutica del SNS. Esta resolución tiene efecto en todo el territorio nacional.
¿Qué proceso sigue un medicamento para ser financiado en España?
El proceso que debe seguir un medicamento para ser financiado por la sanidad pública se inicia con una autorización para ser comercializado en España, tras comprobar que es seguro y eficaz. Puede ser autorizado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) o la Agencia Europea del Medicamento (EMA). Esta última es obligatoria para los fármacos de mayor impacto (página 3) como los destinados al tratamiento del cáncer o los desarrollados mediante biotecnología. Una vez autorizado el medicamento, el laboratorio titular solicita a la AEMPS su registro para obtener un código nacional y el Ministerio de Sanidad inicia de oficio el proceso de evaluación de financiación y fijación del precio, que será decidido en la Comisión Interministerial y ratificado por la Dirección General de Cartera Común de Servicios.
La decisión sobre si un medicamento será financiado con fondos públicos o no es un proceso transparente y regulado por el artículo 92 de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. Se basa en una serie de criterios técnicos y científicos que evalúan la gravedad de la patología y sus secuelas, el “valor terapéutico y social del medicamento”, incluyendo su beneficio clínico incremental y “la relación coste-efectividad”.
También se tiene en cuenta la racionalización del gasto público y el impacto presupuestario en el SNS, la existencia de alternativas terapéuticas a menor precio o el grado de innovación del medicamento. Desde 2018 se han implementado medidas de transparencia (página 8 del documento del Ministerio de Sanidad) que incluyen la publicación de los criterios en los que se basan las decisiones sobre la incorporación o exclusión de medicamentos del sistema público, así como de su precio.





