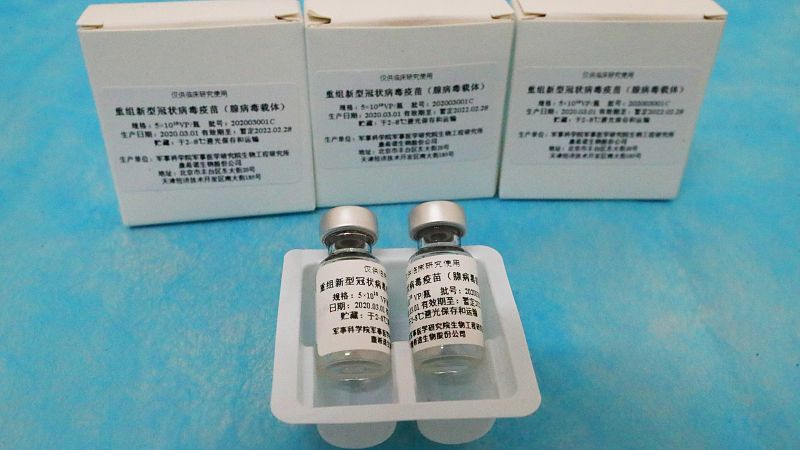
- El consorcio CARE, integrado por once países, pretende acelerar el descubrimiento de medicamentos
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
- Desarrollada por CanSino, está en la fase 2 de ensayos clínicos y podría "ser producida en masa en breve"
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
"Siempre de Guardia" es el lema con el que los farmacéuticos están reivindicando el trabajo que han desempeñado durante la pandemia. Ana López Casero, miembro del comité Directivo del Consejo General de Colegios Oficiales de Farmacéuticos, ha recordado en Las mañanas de RNE con Íñigo Alfonso que la suya "es una profesión con gran vocación de servicio público que también ha sufrido mucho durante esta pandemia" y por eso este homenaje que ha recuperado la mítica serie Farmacia de Guardia.
- La candidata estadounidense es una de las más prometedoras de las 160 que se están desarrollando a nivel mundial
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
Un tratamiento celular desarrollado y probado por investigadores españoles ha demostrado en sus primeros resultados que reduce la mortalidad de los pacientes críticos de coronavirus, según han informado este miércoles fuentes de la Universidad Miguel Hernández (UMH) de Elche.
El medicamento celular ha sido probado en trece pacientes intubados en ventilación mecánica, ingresados en UCI, y ha demostrado ser eficiente para la mejoría clínica de casos críticos de COVID-19.
Investigadores españoles desarrollan un tratamiento celular que reduce la mortalidad de COVID-19
- Los primeros resultados indican que sería capaz de rebajar las muertes de pacientes críticos del 85% al 15%
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
La Comisión Europea ha autorizado este viernes la comercialización condicional en el bloque del remdesivir, el antiviral para tratar la COVID-19, apenas una semana después de que la Agencia Europea del Medicamento (EMA) recomendara su uso, según ha informado en un comunicado.
Bruselas ha destacado que este permiso se ha conseguido en un plazo "excepcionalmente corto" gracias al procedimiento acelerado que ha contado con el visto bueno también de los Estados miembros y que ha permitido acortar los tiempos frente a los 67 días de media que se suele tardar en conceder estas autorizaciones.
Las autorizaciones condicionales son otorgadas a aquellos fármacos en los que los beneficios derivados de su uso compensan el riesgo derivado de que haya menos datos de los que normalmente se exigen para las autorizaciones completas, según explica la EMA en su página web.
- Lo hace tan solo una semana después de que la Agencia Europea del Medicamento recomendara su uso
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España| Mapa de la nueva normalidad | Qué se sabe de la vacuna
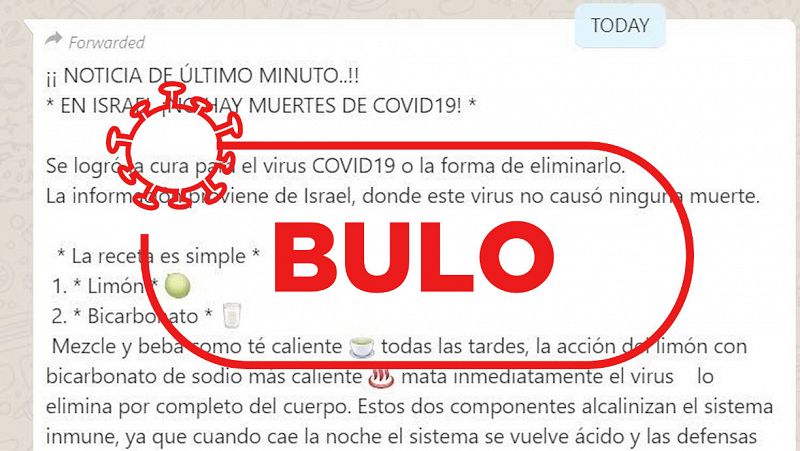
- Analizamos cada jornada los bulos que circulan en redes sociales sobre el coronavirus
- Escríbenos por whatsapp al 676 676 148 y verificamos por ti los mensajes que recibas
- ¿Qué es el coronavirus? | Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
- Coronavirus: última hora en directo
Un fármaco de la española PharmaMar muestra una efectividad "80 veces superior" a la del remdesivir
- Se trata de un antitumoral llamado Aplidin, cuyos ensayos para la COVID-19 están aún en fase preclínica
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España| Mapa de la nueva normalidad | Qué se sabe de la vacuna
- Intenta garantizar el suministro a la UE después de que EE.UU. haya acaparado el 'stock' mundial del medicamento
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España| Mapa de la nueva normalidad | Qué se sabe de la vacuna
España tiene por ahora suficiente suministro de remdesivir. Es lo que asegura la Agencia Española de Medicamentos. El fármaco, todavía experimental, ha levantado mucha expectación en el tratamiento de la COVID-19. Sobre todo desde que el Gobierno de Estados Unidos haya comprado prácticamente todas las existencias.
La farmacéutica estadounidense Pfizer y la firma alemana BioNTech han anunciado resultados positivos en sus ensayos iniciales en humanos con la vacuna para el coronavirus en la que están trabajando.
El estudio incluyó a 45 adultos de entre 18 y 55 años y en él se probaron distintas dosis de la vacuna que, según las empresas, produjeron anticuerpos superiores a los de pacientes que se han recuperado de la COVID-19.
Ahora, las dos compañías prevén usar la información recabada para llevar a cabo una prueba mucho más amplia, con hasta 30.000 participantes, y que esperan comenzar a finales de julio si se recibe el visto bueno de los reguladores.
El Departamento de Salud de Estados Unidos (HHS) ha llegado a un acuerdo con el laboratorio estadounidense que produce el remdesivir, el primer tratamiento autorizado para el coronavirus, para asegurarse el total de la producción en el mes de julio, según ha anunciado en su página web.
El pacto con Gilead Sciences se extiende hasta septiembre y permitirá a los hospitales estadounidenses comprar el medicamento en las cantidades asignadas por el HHS y los departamentos de salud de los diferentes estados.
- Cinco de los doce proyectos de vacuna españoles financiados por el Gobierno se prueban ya en animales
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España| Mapa de la nueva normalidad | Qué se sabe de la vacuna
La farmacéutica Gilead ha anuciado el precio para el antiviral para combatir la COVID-19, un fármaco ya probado contra el ébola pero sin éxito. Los ensayos clínios apuntaron a que el Remdesivir acortaba el ingreso hospitalario de pacientes graves. La farmacéutica ha anunciado que cobrará el fármaco a 2.340 dólares por paciente, algo más de 2.000 euros, por un tratamiento medio de cinco días en un país desarrollado, pero hay un acuerdo para fabricarlo a un precio inferior en países en vías de desarrollo. [Coronavirus: última hora en directo
El tratamiento de Remdesivir para combatir el coronavirus costará más de 2.000 euros por paciente
- La farmacéutica Gilead ha fijado este precio para el primer fármaco autorizado contra el Covid-19
- Coronavirus: última hora en directo | Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
- Analizamos cada jornada los bulos que circulan en redes sociales sobre el coronavirus
- Escríbenos por whatsapp al 676 676 148 y verificamos por ti los mensajes que recibas
- ¿Qué es el coronavirus? | Mapa de España | Mapa mundial
- Mapa de los brotes en España | Mapa de la nueva normalidad | Qué se sabe de la vacuna
- Coronavirus: última hora en directo